全国统一服务热线
作者: 昆山菲瑞格环保净化科技有限公司 发表时间:2018-11-07 22:07:37浏览量:【小中大】
医药工业洁净室(区)沉降菌的测试方法
2010-09-02发布2011-02-01实施
中华人民共和国国家质量监督检验检疫总局发布
国家标准化管理委员会
本标准参考了ISO 14698-1《洁净间以及相关环境控制第1部分:微生物控制》,ISO/TS 11133-1:2000(英文版)《食品和动物饲料的微生物学培养基制备和生产指南第1部分:实验室培养基制备的质量保证通用指南》。本标准代替GB/T 16294-1996《医药工业洁净室(区)沉降菌的测试方法》。
本标准与GB/T 16294-1996的主要区别为:—增加了确定最少采样点数目的方法;—修改了原标准4.8.3.2,改为“4.10.2采用大豆酪蛋白琼脂培养基(TSA)配制的培养皿经采样后,在30℃~35℃培养箱中培养,时间不少于2d,采用沙氏培养基(SDA)配制的培养皿经采样后,在20℃~25℃培养箱中培养,时间不少于5d。”;
医药工业洁净室(区)沉降菌的测试方法
1 范 围
本标准规定了医药工业洁净室和洁净区中沉降菌测试条件、测试方法。
本标准适用于医药工业洁净室和洁净区,无菌室或局部空气净化区域(包括洁净工作台)的沉降菌的测试和环境的验证。
2 规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T 16292-2010医药工业洁净室(区)悬浮粒子的测试方法
3 术语和定义
下列术语和定义适用于本标准。
3.1沉降菌settling microbe:用本标准提及的方法收集空气中的活微生物粒子,通过专门的培养基,在适宜的生长条件下繁殖到可见的菌落数。
3.2沉降菌菌落数settling microbe plate count规定时间内每个平板培养皿收集到空气中沉降菌的数目,以个/皿表示。
4 测试方法
4.1方法提要:本测试方法采用沉降法,即通过自然沉降原理收集在空气中的生物粒子于培养基平皿,经若干时间,在适宜的条件下让其繁殖到可见的菌落进行计数,以平板培养皿中的菌落数来判定洁净环境内的活微生物数,并以此来评定洁净室(区)的洁净度。
4.2人员的职责及培训:洁净室(区)的测试人员应进行本专业的培训并获得相应资格后才能履行对洁净室(区)测试的职责,其中包含涉及的卫生知识和基本微生物知识。洁净室(区)的测试人员应选与生产操作的空气洁净度级别要求相适应的穿戴方式,外面的衣服不能带进100000级以上的区域。
4.3仪器
仪器应包括:a)培养皿;b)培养基(见本标准附录B);c)恒温培养箱;d)高压蒸汽灭菌器。
4.3.1培养皿:一般采用φ90mm×15mm规格的培养皿。
4.3.2培养基:大豆酪蛋白琼脂培养基(TSA)或沙氏培养基(SDA)或其他用户认可并经验证了的培养基。其配制方法见附录B。
4.3.3恒温培养箱:必须定期对恒温培养箱进行校验。
4.4测试步骤
4.4.1测试前培养基表面必须严格消毒。
4.4.2将已制备好的培养皿按采样点布置图逐个放置,然后从里到外逐个打开培养皿盖,使培养基表面暴露在空气中。
4.4.3静态测试时,培养皿暴露时间为30min以上;动态测试时,培养皿暴露时间为不大于4h。
4.4.4全部采样结束后,将培养皿倒置于恒温培养箱中培养。
4.4.5采用大豆酪蛋白琼脂培养基(TSA)配制的培养皿经采样后,在30℃~35℃培养箱中培养,时间不少于2d;采用沙氏培养基(SDA)配制的培养基经采样后,在20℃~25℃培养箱中培养,时间不少于5d。
4.4.6每批培养基应有对照试验,检验培养基本身是否污染。可每批选定3只培养皿作对照培养。
4.5菌落计数
4.5.1用肉眼对培养皿上所有的菌落直接计数、标记或在菌落计数器上点计,然后用5~10倍放大镜检查,有否遗漏。
4.5.2若平板上有2个或2个以上的菌落重叠,可分辨时仍以2个或2个以上菌落计数。
4.6注意事项
4.6.1测试用具要作灭菌处理,以确保测试的可靠性、正确性。
4.6.2采取一切措施防止人为对样本的污染。
4.6.3对培养基、培养条件及其他参数作详细的记录。
4.6.4由于细菌种类繁多,差别甚大,计数时一般用透射光于培养皿背面或正面仔细观察,不要漏计培养皿边缘生长的菌落,并须注意细菌菌落与培养基沉淀物的区别,必要时用显微镜鉴别。
4.6.5采样前应仔细检查每个培养皿的质量,如发现变质、破损或污染的应剔除。
5 测试规则
5.1测试条件在测试之前,要对洁净室(区)相关参数进行预先测试,这类测试将会提供测试沉降菌的环境条件,例如:这种预先测试或可包括:
a)温度和相对湿度的测试。洁净室(区)的温度和相对湿度应与其生产及工艺要求相适应(无特殊要求时,温度在18℃~26℃,相对湿度在45%~65%为宜)。同时应满足测试仪器的使用范围;
b)室内送风量或风速的测试,或压差的测试;
c)高效过滤器的泄漏测试;
5.2测试状态:静态和动态两种状态均可进行测试。静态测试时,室内测试人员不得多于2人。沉降菌测试前,被测洁净室(区)由使用者决定是否需要预先消毒。测试报告中应标明测试时所采用的状态和室内测试人员数。
5.3测试时间
5.3.1在空态或静态a测试时,对单向流洁净室(区)而言,测试宜在净化空气调节系统正常运行时间不少于10min后开始。对非单向流洁净室(区),测试宜在净化空气调节系统正常运行时间不少于30min后开始。在静态b测试时,对单向流洁净室(区),测试宜在生产操作人员撤离现场并经过10min自净后开始;对非单向流洁净室(区),测试宜在生产操作人员撤离现场并经过20min自净后开始。
5.3.2在动态测试时,则须记录生产开始的时间以及测试时间。
5.4沉降菌菌落数计算
5.4.1采样点数量及其布置
5.4.1.1最少采样点数目沉降菌测试的最少采样点数目可参照GB/T 16292-2010。
5.4.1.2采样点的位置沉降菌的采样点位置可参照GB/T 16292-2010。
a)工作区采样点位置离地0.8m~1.5m左右(略高于工作面);
b)可在关键设备或关键工作活动范围处增加测点。采样点布置的规则见附录A。
5.4.2最少培养皿数在满足最少采样点数目的同时,还宜满足最少培养皿数,见表1。
*表1最少培养皿数*
|
洁净度级别 |
最少培养皿数(φ90mm) |
|
100 |
14 |
|
10000 |
2 |
|
100000 |
2 |
|
300000 |
2 |
5.4.3采样次数:每个采样点一般采样一次。
5.4.4采样注意事项
5.4.4.1对于单向流洁净室(区)或送风口,采样器采样口朝向应正对气流方向;对于非单向流洁净室(区),采样口向上。
5.4.4.2布置采样点时,至少应尽量避开尘粒较集中的回风口。
5.4.4.3采样时,测试人员应站在采样口的下风侧,并尽量少走动。
5.4.4.4应采取一切措施防止采样过程的污染和其他可能对样本的污染。
5.4.4.5培养皿在用于检测时,为避免培养皿运输或搬动过程造成的影响,宜同时进行对照试验,每次或每个区域取1个对照皿,与采样皿同法操作但不需暴露采
样,然后与采样后的培养皿(TSA或SDA)一起放入培养箱内培养,结果应无菌落生长。
5.5记录:测试报告应包含以下内容:
a)测试者的名称和地址,测试日期;b)测试依据;c)被测洁净室(区)的平面位置(必要时标注相邻区域的平面位置);d)有关测试仪器及其测试方法的描述:包括测试环境条件,采样点数目以及布置图,测试次数,或可能存在的测试方法的变更,测试仪器的检定证书等;若为动态测试,则还应记录现场操作人员数量及位置,现场设备运转数量及位置等;e)测试结果;包括所有统计计算资料。
5.6结果计算
5.6.1用计数方法得出各个培养皿的菌落数。
5.6.2每个测点的沉降菌平均菌落数的计算,见式(1)。沉降菌平均菌落数的计算公式
5.7结果评定
5.7.1每个测点的沉降菌平均菌落数必须低于所选定评定标准中的界限。
5.7.2在静态测试时,若某测点的沉降菌平均菌落数超过评定标准,则应重新采样两次,两次测试结果均合格才能判为符合。
5.8日常监控对于沉降菌的监控,宜设定纠偏限度和警戒限度,以保证洁净室(区)的微生物浓度受到控制。应定期检测以检查微生物负荷以及消毒剂的效力,并作倾向分析。静态和动态的监控都可以采用该方法。对于沉降菌的取样频次,如果出现下列情况应考虑修改,在评估以下情况后,也应确定其他项目的检测频次:—连续超过纠偏限度和警戒限度;—停工时间比预计延长;—关键区域内发现有污染存在;—在生产期间,空气净化系统进行任何重大的维修;—日常操作记录反映出倾向性的数据;—消毒规程的改变;—引起生物污染的事故等;—当生产设备有重大维修或增加设备时;—当洁净室(区)结构或区域分布有重大变动时。
附录A(规范性附录)洁净室(区)采样点布置
A.l洁净室(区)采样点布置宜力求均匀,避免采样点在局部区域过于稀疏。下列多点采样的采样点布置图示可作参考
A.2 100级单向流区域,洁净工作台或局部空气净化设施的采样点宜布置在正对气流方向的工作面上,气流形式可参考图A.2、
附录B(规范性附录)培养基的灭菌及准备
*B.1大豆酪蛋白琼脂培养基(TSA)培养基的灭菌及准备*
B.1.1培养基采用大豆酪蛋白琼脂培养基,可以按以下处方制备,也可使用按该处方生产的符合要求的脱水培养基。配制后按培养基规定的经验证合格的灭菌程序灭菌。
B.1.2大豆酪蛋白琼脂培养基配方
酪蛋白胰酶消化物……………………………………………………15g
大豆粉木瓜蛋白酶消化物……………………………………………5g
氯化钠…………………………………………………………………5g
琼脂……………………………………………………………………15g
纯化水……………………………………………………………1000mL
取上述成分除琼脂,混合,微热溶解,调节pH值使灭菌后为7.3±0.2,加入琼脂,加热融化后,分装,灭菌,冷却至约60℃,在无菌操作要求下倾注约20mL至无菌平皿(φ90mml))中。加盖后在室温放至凝固。
*B.2沙氏琼脂培养基(SDA)培养基的灭菌及准备*
萄萄糖………………………………………………………………40g
酪蛋白胰酶消化物、动物组织的胃酶消化物等量混合…………10g
琼脂…………………………………………………………………15g
纯化水…………………………………………………………1000mL
取上述成分除琼脂,混合,微热溶解,调节pH值使灭菌后为5.6±0.2,加入琼脂,加热融化后,分装,灭菌,冷却至约60℃,在无菌操作要求下倾注约20mL至无菌平皿(φ90mml))中。加盖后在室温放至凝固。
*B.3培养基平皿培养及保存*
制备好的培养基平皿宜在2℃~8℃保存,一般以一周为宜或按厂商提供的标准执行。采用适宜方法在平皿上做好培养基的名称、制备日期记录的标记。
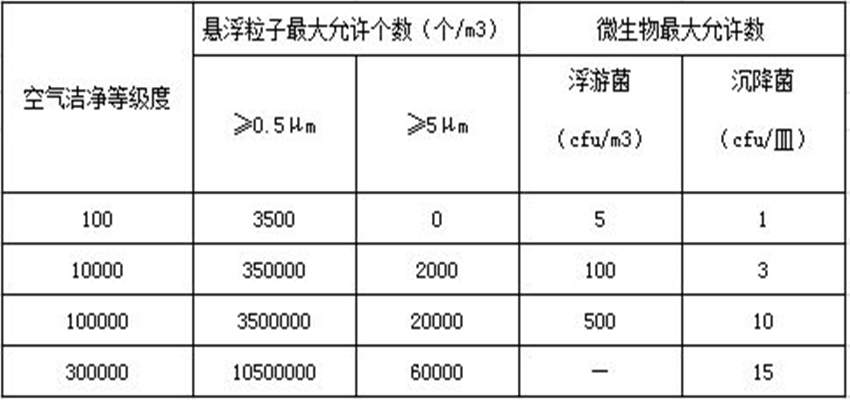
注1):如采用其他规格的平皿,可适当增减培养基的量,使之在平皿中形成至少2mm厚的琼脂层。洁净室沉降菌测试对应表如下:

微信公众号
活动、资讯早知道
联系我们